 Los isótopos son átomos que tienen el mismo número atómico, pero diferente número másico, lo cual quire decir que un mismo elemento puede "pesar" diferente. La mayoría de los elementos tiene dos ó más isótopos. La diferencia en peso entre dos isótopos de un elemento es el número de neutrones en el núcleo. Fijese en la figura de la izquierda (cortesia de paxprofundis.org) en donde se muestran tres atomos, todos del Hidrogeno. Cual es la diferencia entre estos tres atomos?)
Los isótopos son átomos que tienen el mismo número atómico, pero diferente número másico, lo cual quire decir que un mismo elemento puede "pesar" diferente. La mayoría de los elementos tiene dos ó más isótopos. La diferencia en peso entre dos isótopos de un elemento es el número de neutrones en el núcleo. Fijese en la figura de la izquierda (cortesia de paxprofundis.org) en donde se muestran tres atomos, todos del Hidrogeno. Cual es la diferencia entre estos tres atomos?)El número de neutrones de un elemento químico se puede calcular como A-Z, es decir, como la diferencia entre el número másico y el número atómico. Por ejemplo, para el carbono Z=6. Es decir, todos los átomos de carbono tienen 6 protones y 6 electrones. Sin embargo, el carbono tiene dos isótopos: uno con A=12, con 6 neutrones y otro con número másico 13 (7 neutrones), que se representan como:
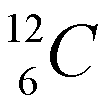
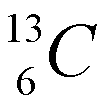
La cantidad relativa de un isótopo en la naturaleza recibe el nombre de abundancia isotópica natural. La masa atómica de un elemento es una media de las masas de sus isotópos naturales ponderada de acuerdo a su abundancia relativa. Por ejemplo, La plata (Ag) en su estado natural está constituida por una mezcla de dos isótopos de números másicos 107 y 109. Sabiendo que abundancia isotópica es la siguiente: 107Ag =56% y 109Ag =44%, el peso atómico de la plata natural se calcula como:

En general las propiedades químicas de un elemento están determinadas fundamentalmente por los protones y electrones de sus átomos y en condiciones normales los neutrones no participan en los cambios químicos. Por ello los isótopos de un elemento tendrán un comportamiento químico similar, formarán el mismo tipo de compuestos y reaccionarán de manera semejante.



No hay comentarios.:
Publicar un comentario