Ante la diversidad de elementos químicos existentes en la naturaleza cabe preguntarse cuál es la razón por la que unos átomos se reúnen formando una molécula y otros no; o de otra manera, por qué no toda molécula o agrupación de átomos imaginable tiene existencia real. Una primera respuesta puede hallarse en la tendencia observada en todo sistema físico a alcanzar una condición de mínima energía. Aquella agrupación de átomos que consiga reducir la energía del conjunto dará lugar a una molécula, definiendo una forma de enlace químico que recibe el nombre de enlace covalente.
Junto con esa idea general de configuración de energía mínima, otros intentos de explicación de este tipo de enlace entre átomos han sido planteados recurriendo a las características fisicoquímicas de las estructuras electrónicas de los átomos componentes.
La teoría de Lewis
El químico estadounidense G. B. Lewis (1875-1946) advirtió que el enlace químico entre átomos no podía explicarse como debido a un intercambio de electrones. Dos átomos iguales intercambiando electrones no alterarían sus configuraciones electrónicas; las ideas válidas para el enlace iónico no eran útiles para explicar de una forma general el enlace entre átomos. Sugirió entonces que este tipo de enlace químico se formaba por la comparación de uno o más pares de electrones o pares de enlace. Por este procedimiento los átomos enlazados alcanzaban la configuración electrónica de los gases nobles. Este tipo de configuración de capas completas se corresponde con las condiciones de mínima energía o máxima estabilidad características de la situación de enlace.
La teoría de Lewis, conocida también como teoría del octete por ser éste el número de electrones externos característicos de los gases nobles, puede explicar, por ejemplo, la formación de la molécula de yodo I2:
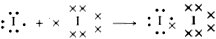
Ambos átomos, que individualmente considerados tienen siete electrones en su capa externa, al formar la molécula de yodo pasan a tener ocho mediante la comparación del par de enalce .
Existen moléculas cuya formación exige la comparación de más de un par de electrones. En tal caso se forma un enlace covalente múltiple. Tal es el caso de la molécula de oxígeno O2:

para cuya formación se comparten dos pares de electrones. Representado cada par de electrones mediante una línea resulta:
que indica más claramente la formación de un doble enlace.
En la molécula de nitrógeno N2 sucede algo semejante, sólo que en este caso se han de compartir tres pares de electrones para alcanzar el octete, con la formación consiguiente de un triple enlace:
 Esta explicación puede extenderse al caso de las moléculas formadas por átomos de elementos no metálicos diferentes entre sí, tales como HCl o NH3 por ejemplo:
Esta explicación puede extenderse al caso de las moléculas formadas por átomos de elementos no metálicos diferentes entre sí, tales como HCl o NH3 por ejemplo:
Lewis contempló la posibilidad extrema de que los pares electrónicos de enlace fueran aportados por un sólo átomo. Tal es el caso del ion amonio en el cual el atomo de nitrogeno aporta el par de electrones al enlace con el ion H+:
 Este tipo de enlace covalente se denomina coordinado.
Este tipo de enlace covalente se denomina coordinado. Los subíndices que aparecen en las fórmulas químicas de compuestos covalentes expresan el número de átomos que se combina para formar una molécula y están, por tanto, relacionados con la capacidad de enlace de cada uno de ellos, también llamada valencia química. Según la teoría de Lewis, la configuración electrónica de la capa externa condiciona dicha capacidad y es la responsable del tipo de combinaciones químicas que un determinado elemento puede presentar.
La teoría del enlace de valencia
La superación del modelo de Bohr y el desarrollo del modelo atómico de la mecánica cuántica tuvo una clara repercusión en las ideas sobre el enlace químico en general y sobre el covalente en particular. Uno de los enfoques mecanocuánticos del enlace covalente se conoce como teoría del enlace de valencia y permite comprender en términos no sólo de energías, sino también de fuerzas, el fenómeno del enlace entre átomos.
La formación del enlace covalente simple tiene lugar cuando los orbitales correspondientes a dos electrones desapareados de átomos diferentes se superponen o solapan, dando lugar a una región común en la cual los dos electrones con espines opuestos, tal y como exige el principio de exclusión de Pauli, ocupan un mismo orbital. Ese par compartido constituye el elemento de enlace entre los dos átomos. Así, por ejemplo, cuando dos átomos de H se aproximan suficientemente, existe una disposición en la cual sus nubes electrónicas están parcialmente solapadas y para la que la energía potencial del conjunto es mínima, constituyendo, pues, una situación de enlace. En términos electrónicos puede afirmarse que el orbital 1s de cada átomo de hidrógeno, semiocupado por su electrón correspondiente, es completado por el electrón del otro átomo de hidrógeno. Los dos electrones con espines opuestos de este par, son atraídos entonces por cada uno de los núcleos, constituyendo el par de enlace. La existencia de este par común es lo que determina que los núcleos estén ligados entre sí con las limitaciones que, en cuanto a proximidad, imponen las fuerzas de repulsión nuclear.
La idea de comparación de electrones de Lewis sigue, de algún modo, presente en la teoría del enlace de valencia, aunque se abandona la regla del octete y se sustituye por la condición de que dos electrones desapareados puedan ocupar un mismo orbital. El número de enlaces covalentes posible depende, entonces, del número de electrones desapareados presentes en el átomo correspondiente o en algún estado excitado previo a la formación de la molécula
chemistry education, chemical bonds, practices of laboratory, lab work, problems and solutions



1 comentario:
mas o menos
Publicar un comentario