Rafael Borneo. PhD. Profesor Asociado. Cátedra Química Aplicada. Universidad Nacional de Córdoba
28/8/09
Reactivo Limitante y Reactivo en Exceso
Reactivo limitante
Cuando una reacción se detiene porque se acaba uno de los reactivos, a ese reactivo se le llama reactivo limitante.
Aquel reactivo que se ha consumido por completo en una reacción química se le conoce con el nombre de reactivo limitante pues determina o limita la cantidad de producto formado.
Reactivo limitante es aquel que se encuentra en defecto basado en la ecuación química ajustada.
Ejemplo
Fíjese en la siguiente reacción:
2H2 +O2-> 2H2O
Suponga que hay 10 moléculas de hidrógeno y 10 moléculas de oxígeno y sucede la reacción. ¿Cuál será el reactivo limitante?
Se necesitan 2 moléculas de H2 por cada molécula de O2 (La proporción requerida es de 2 : 1)
Pero tenemos sólo 10 moléculas de H2 y 10 moléculas de O2.
Es claro que el reactivo en exceso es el O2 y el reactivo limitante es el H2
Trabajar con moléculas es lo mismo que trabajar con moles ya que la relación estequiométrica es la misma (2:1) pero en moles.
Ahora suponga que mezclamos 15 moles de H2 con 5 moles de O2. La estequiometría de la reacción es siempre tal que 1 mol de O2 reaccionan con 2 moles de H2, entonces el número de moles de O2 necesarios para reaccionar con todo el H2 es 7,5, y el número de moles de H2 necesarias para reaccionar con todo el O2 es 10.
Es decir, que después que todo el oxígeno se ha consumido, sobrarán 5 moles de hidrógeno. Por lo tanto el O2 es el reactivo limitante
Rendimiento Teorico y Real
Rendimiento teórico
La cantidad de producto que debiera formarse si todo el reactivo limitante se consumiera en la reacción, se conoce con el nombre de rendimiento teórico.
A la cantidad de producto realmente formado se le llama simplemente rendimiento o rendimiento (real) de la reacción. Es claro que siempre se cumplirá la siguiente desigualdad
Rendimiento (real) de la reacción es menor rendimiento teórico
Razones de este hecho:
es posible que no todos los productos reaccionen
es posible que haya reacciones laterales que no lleven al producto deseado
la recuperación del 100% de la muestra es prácticamente imposible
Problema: La reacción de 6.8 g de H2S con exceso de SO2, según la siguiente reacción, produce 8.2 g de S. ¿Cual es el rendimiento? (Pesos Atómicos: H = 1.0, S = 32.0, O = 16.00).
Resultado: 85,4%
Estequiometria de una reaccion quimica
¿Que es una reacción química?
Reacción química es el proceso en el cual una sustancia (o sustancias) cambia para formar una o más sustancias nuevas, es decir es un proceso de cambio de unos reactivos iniciales a unos productos finales
Las reacciones químicas se representan mediante ecuaciones químicas. Por ejemplo el carbono (C) podría reaccionar con oxígeno gaseoso (O2) para formar dióxido de carbono(CO2). La ecuación química para esta reacción se escribe:
C + O2 = CO2
El '+' se lee como “reacciona con” y la flecha significa “produce”. Las fórmulas químicas a la izquierda de la flecha representan las sustancias de partida denominadas reactivos. A la derecha de la flecha están las formulas químicas de las sustancias producidas denominadas productos de la reacción. Los números al lado de las formulas son los coeficientes( el coeficiente 1 se omite).
En la reacción anterior el C y el O2 son los reactivos, el CO2 el producto.
La reacción de formación del agua se escribe:
2H2 + O2 = 2H2O
Nótese en la reacción anterior (formación del agua) que el numero de átomos de cada elemento a cada lado de la ecuación es el mismo:
Según la ley de la conservación de la masa los átomos ni se crean, ni se destruyen, durante una reacción química. Por lo tanto una ecuación química ha de tener el mismo número de átomos de cada elemento a ambos lados de la flecha. Se dice entonces que la ecuación está balanceada.
Como se balancean las ecuaciones químicas?
1) Se sigue un procedimiento estandarizado que se describe a continuación:
2) Se determinan los reactivos y los productos de la reacción química
3) Se escribe la ecuación química reactivos a productos
4) Se balancea la ecuación de la siguiente forma:
-- Se empieza por igualar la ecuación probando diferentes coeficientes para lograr que el número de átomos de cada elemento sea igual en ambos lados de la ecuación. Los subíndices de las fórmulas no se pueden cambiar).
-- Primero se buscan los elementos que aparecen una sola vez en cada lado de la ecuación y con igual número de átomos: las fórmulas que contienen estos elementos deben tener el mismo coeficiente. Por lo tanto, no es necesario ajustar los coeficientes de estos elementos en ese momento.
-- Después se buscan los elementos que aparecen sólo una vez en cada lado de la ecuación, pero con diferente número de átomos y se balancean estos elementos. Por último se balancean los elementos que aparecen en dos o más fórmulas del mismo lado de la ecuación.
--Se verifica que la ecuación igualada tenga el mismo número total de átomos de cada tipo en ambos lados de la flecha de la ecuación.
Ejemplo:
Consideremos la combustión del gas metano (CH4). Esta reacción consume oxígeno (O2) y produce agua (H2O) y dióxido de carbono (CO2). Podemos entonces escribir la ecuación química:
CH4 + O2 = CO2 + H2O
Ahora contamos el número de átomos de cada elemento en reactivos y productos:
Reactivos:
C =1, H = 4, O = 2
Productos:
C = 1, H = 2, O = 3,
El carbono y el hidrógeno aparecen en un compuesto de los reactivos y en otro de los productos.
Hay igual numero de átomos de carbono en los reactivos que en los productos, pero dos veces más hidrógeno en los reactivos que en los productos y 1,5 veces mas oxigeno en los productos que en los reactivos.
Esto se puede arreglar balanceando la reacción, de manera de igualar el numero de átomos de cada especie química en cada lado de la ecuación. El carbono ya esta igualado, o sea no hay que hacer nada. Para el H hay que multiplicar por dos (2) en el agua, así ahora hay 4 átomos de H a cada lado. Pero ahora tenemos que a la derecha (productos) hay 4 átomos de oxigeno (dos del CO2 y dos del 2H2O), mientras que a la izquierda solo dos, por lo cual hay que multiplicar por dos el Oxigeno de la izquierda (reactivos)
CH4 + 2O2 = CO2 + 2H2O
Ahora ya tenemos la ecuación balanceada y la podemos leer como:
una molécula de metano reaccionan con dos de oxígeno produciendo una molécula de dióxido de carbono y dos moléculas de agua.
El estado físico de los reactivos y productos puede indicarse mediante los símbolos (g), (l) y (s), para indicar los estados gaseoso, líquido y sólido, respectivamente.
Por ejemplo:
CH4(g) + 2O2(g) = CO2(g) + 2H2O (l)
17/8/09
Enlace Quimico: Como se forman?
Ante la diversidad de elementos químicos existentes en la naturaleza cabe preguntarse cuál es la razón por la que unos átomos se reúnen formando una molécula y otros no; o de otra manera, por qué no toda molécula o agrupación de átomos imaginable tiene existencia real. Una primera respuesta puede hallarse en la tendencia observada en todo sistema físico a alcanzar una condición de mínima energía. Aquella agrupación de átomos que consiga reducir la energía del conjunto dará lugar a una molécula, definiendo una forma de enlace químico que recibe el nombre de enlace covalente.
Junto con esa idea general de configuración de energía mínima, otros intentos de explicación de este tipo de enlace entre átomos han sido planteados recurriendo a las características fisicoquímicas de las estructuras electrónicas de los átomos componentes.
La teoría de Lewis
El químico estadounidense G. B. Lewis (1875-1946) advirtió que el enlace químico entre átomos no podía explicarse como debido a un intercambio de electrones. Dos átomos iguales intercambiando electrones no alterarían sus configuraciones electrónicas; las ideas válidas para el enlace iónico no eran útiles para explicar de una forma general el enlace entre átomos. Sugirió entonces que este tipo de enlace químico se formaba por la comparación de uno o más pares de electrones o pares de enlace. Por este procedimiento los átomos enlazados alcanzaban la configuración electrónica de los gases nobles. Este tipo de configuración de capas completas se corresponde con las condiciones de mínima energía o máxima estabilidad características de la situación de enlace.
La teoría de Lewis, conocida también como teoría del octete por ser éste el número de electrones externos característicos de los gases nobles, puede explicar, por ejemplo, la formación de la molécula de yodo I2:
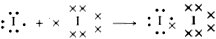
Ambos átomos, que individualmente considerados tienen siete electrones en su capa externa, al formar la molécula de yodo pasan a tener ocho mediante la comparación del par de enalce .
Existen moléculas cuya formación exige la comparación de más de un par de electrones. En tal caso se forma un enlace covalente múltiple. Tal es el caso de la molécula de oxígeno O2:

para cuya formación se comparten dos pares de electrones. Representado cada par de electrones mediante una línea resulta:
que indica más claramente la formación de un doble enlace.
En la molécula de nitrógeno N2 sucede algo semejante, sólo que en este caso se han de compartir tres pares de electrones para alcanzar el octete, con la formación consiguiente de un triple enlace:
 Esta explicación puede extenderse al caso de las moléculas formadas por átomos de elementos no metálicos diferentes entre sí, tales como HCl o NH3 por ejemplo:
Esta explicación puede extenderse al caso de las moléculas formadas por átomos de elementos no metálicos diferentes entre sí, tales como HCl o NH3 por ejemplo:
Lewis contempló la posibilidad extrema de que los pares electrónicos de enlace fueran aportados por un sólo átomo. Tal es el caso del ion amonio en el cual el atomo de nitrogeno aporta el par de electrones al enlace con el ion H+:
 Este tipo de enlace covalente se denomina coordinado.
Este tipo de enlace covalente se denomina coordinado. Los subíndices que aparecen en las fórmulas químicas de compuestos covalentes expresan el número de átomos que se combina para formar una molécula y están, por tanto, relacionados con la capacidad de enlace de cada uno de ellos, también llamada valencia química. Según la teoría de Lewis, la configuración electrónica de la capa externa condiciona dicha capacidad y es la responsable del tipo de combinaciones químicas que un determinado elemento puede presentar.
La teoría del enlace de valencia
La superación del modelo de Bohr y el desarrollo del modelo atómico de la mecánica cuántica tuvo una clara repercusión en las ideas sobre el enlace químico en general y sobre el covalente en particular. Uno de los enfoques mecanocuánticos del enlace covalente se conoce como teoría del enlace de valencia y permite comprender en términos no sólo de energías, sino también de fuerzas, el fenómeno del enlace entre átomos.
La formación del enlace covalente simple tiene lugar cuando los orbitales correspondientes a dos electrones desapareados de átomos diferentes se superponen o solapan, dando lugar a una región común en la cual los dos electrones con espines opuestos, tal y como exige el principio de exclusión de Pauli, ocupan un mismo orbital. Ese par compartido constituye el elemento de enlace entre los dos átomos. Así, por ejemplo, cuando dos átomos de H se aproximan suficientemente, existe una disposición en la cual sus nubes electrónicas están parcialmente solapadas y para la que la energía potencial del conjunto es mínima, constituyendo, pues, una situación de enlace. En términos electrónicos puede afirmarse que el orbital 1s de cada átomo de hidrógeno, semiocupado por su electrón correspondiente, es completado por el electrón del otro átomo de hidrógeno. Los dos electrones con espines opuestos de este par, son atraídos entonces por cada uno de los núcleos, constituyendo el par de enlace. La existencia de este par común es lo que determina que los núcleos estén ligados entre sí con las limitaciones que, en cuanto a proximidad, imponen las fuerzas de repulsión nuclear.
La idea de comparación de electrones de Lewis sigue, de algún modo, presente en la teoría del enlace de valencia, aunque se abandona la regla del octete y se sustituye por la condición de que dos electrones desapareados puedan ocupar un mismo orbital. El número de enlaces covalentes posible depende, entonces, del número de electrones desapareados presentes en el átomo correspondiente o en algún estado excitado previo a la formación de la molécula
Que es el enlace metalico?
 Un enlace metálico es un enlace químico que mantiene unidos los átomos de los metales entre sí. Estos átomos se agrupan de forma muy cercana unos a otros, lo que produce estructuras muy compactas. Se trata de redes tridimensionales que adquieren la estructura típica de empaquetamiento compacto de esferas. En este tipo de estructura cada átomo metálico está rodeado por otros doce átomos (seis en el mismo plano, tres por encima y tres por debajo). Además, debido a la baja electronegatividad que poseen los metales, los electrones de valencia son extraídos de sus orbitales y tiene la capacidad de moverse libremente a través del compuesto metálico, lo que otorga las propiedades eléctricas y térmicas de los metales.
Un enlace metálico es un enlace químico que mantiene unidos los átomos de los metales entre sí. Estos átomos se agrupan de forma muy cercana unos a otros, lo que produce estructuras muy compactas. Se trata de redes tridimensionales que adquieren la estructura típica de empaquetamiento compacto de esferas. En este tipo de estructura cada átomo metálico está rodeado por otros doce átomos (seis en el mismo plano, tres por encima y tres por debajo). Además, debido a la baja electronegatividad que poseen los metales, los electrones de valencia son extraídos de sus orbitales y tiene la capacidad de moverse libremente a través del compuesto metálico, lo que otorga las propiedades eléctricas y térmicas de los metales.Las características básicas de los elementos metálicos son producidas por la naturaleza del enlace metálico. Entre ellas destacan:
1. Suelen ser sólidos a temperatura ambiente, excepto el mercurio, y sus puntos de fusión y ebullición varían notablemente.
2. Las conductividades térmicas y eléctricas son muy elevadas. (esto se explica por la enorme movilidad de sus electrones de valencia)
3. Presentan brillo metálico.
4. Son dúctiles y maleables. (la enorme movilidad de los electrones de valencia hace que los cationes metálicos puedan moverse sin producir una situación distinta, es decir, una rotura)
5. Pueden emitir electrones cuando reciben energía en forma de calor.
6. Tienden a perder electrones de sus últimas capas cuando reciben cuantos de luz (fotones), fenómeno conocido como efecto fotoeléctrico.
El enlace metálico es característico de los elementos metálicos, es un enlace fuerte, primario, que se forma entre elementos de la misma especie. Los átomos, al estar tan cercanos uno de otro, interaccionan los núcleos junto con sus nubes electrónicas empaquetándose en las tres dimensiones, por lo que quedan rodeados de tales nubes. Estos electrones libres son los responsables que los metales presenten una elevada conductividad eléctrica y térmica, ya que estos se pueden mover con facilidad si se ponen en contacto con una fuente eléctrica. Presentan brillo y son maleables.
Los elementos con un enlace metálico están compartiendo un gran número de electrones de valencia, formando un mar de electrones rodeando un enrejado gigante de cationes. Los metales tienen puntos de fusión más altos por lo que se deduce que hay enlaces más fuertes entre los distintos átomos. La vinculación metálica es no polar, apenas hay (para los metales elementales puros) o muy poco (para las aleaciones) diferencia de electronegatividad entre los átomos que participan en la interacción de la vinculación, y los electrones implicados en que es la interacción a través de la estructura cristalina del metal. El enlace metálico explica muchas características físicas de metales, tales como fuerza, maleabilidad, ductilidad, conducción del calor y de la electricidad, y lustre. La vinculación metálica es la atracción electrostática entre los átomos del metal o los iones y electrones deslocalizados. Esta es la razón por la cual se explica un deslizamiento de capas, dando por resultado su característica maleabilidad y ductilidad. Los átomos del metal tienen por lo menos un electrón de la valencia, no comparten estos electrones con los átomos vecinos, ni pierden electrones para formar los iones. En lugar los niveles de energía externos de los átomos del metal se traslapan. Son como enlaces covalentes.
Para explicar las propiedades características de los metales (su alta conductividad eléctrica y térmica, ductilidad y maleabilidad, ...) se ha elaborado un modelo de enlace metálico conocido como modelo de la nube o del mar de electrones:Los átomos de los metales tienen pocos electrones en su última capa, por lo general 1, 2 ó 3. Éstos átomos pierden fácilmente esos electrones (electrones de valencia) y se convierten en iones positivos, por ejemplo Na+, Cu2+, Mg2+. Los iones positivos resultantes se ordenan en el espacio formando la red metálica. Los electrones de valencia desprendidos de los átomos forman una nube de electrones que puede desplazarse a través de toda la red. De este modo todo el conjunto de los iones positivos del metal queda unido mediante la nube de electrones con carga negativa que los envuelve.
Como se combinan los atomos?
Los cambios químicos son esencialmente una alteración de los enlaces químicos. De los tres tipos de fuerzas de atracción: gravitacional, magnética y electrostática, sólo la electrostática es lo suficientemente intensa como para justificar las energías de enlace observadas.
Una de las claves de la comprensión de la fuerza del enlace químico, fue el descubrimiento de los gases nobles y de su comportamiento químico relativamente inerte. Se sugirió que los átomos interactúan cambiando el número de electrones de tal forma que adquieren la estructura electrónica de un gas noble. Con excepción del helio, que tiene una configuración 1s2 , cada gas noble tiene ocho electrones con una distribución s2p6 en su nivel energético más elevado. La necesidad de ocho electrones da el nombre de regla del octeto a este concepto. Sin emgbargo, hay muchas excepciones a esta regla (existen elementos que no completan su octeto mientras que otros exceden su octeto) y hasta se han logrado sintetizar algunos compuestos de los gases nobles.
Los enlaces químicos resultan de interacciones electrostáticas y se los clasifican en tres grandes grupos, enlace iónico, enlace covalente y enlace metálico.
1) Enlace iónico: resulta de las interacciones electrostáticas entre iones de cargas opuestas.
2) Enlace covalente: es el resultado de compartir electrones entre dos átomos.
3) Enlace metálico: cada átomo está unido a varios átomos vecinos por electrones que son relativamente libres de moverse a través de la estructura tridimensional.
10/8/09
Material de Vidrio en el Laboratorio
Que son los Isotopos?
 Los isótopos son átomos que tienen el mismo número atómico, pero diferente número másico, lo cual quire decir que un mismo elemento puede "pesar" diferente. La mayoría de los elementos tiene dos ó más isótopos. La diferencia en peso entre dos isótopos de un elemento es el número de neutrones en el núcleo. Fijese en la figura de la izquierda (cortesia de paxprofundis.org) en donde se muestran tres atomos, todos del Hidrogeno. Cual es la diferencia entre estos tres atomos?)
Los isótopos son átomos que tienen el mismo número atómico, pero diferente número másico, lo cual quire decir que un mismo elemento puede "pesar" diferente. La mayoría de los elementos tiene dos ó más isótopos. La diferencia en peso entre dos isótopos de un elemento es el número de neutrones en el núcleo. Fijese en la figura de la izquierda (cortesia de paxprofundis.org) en donde se muestran tres atomos, todos del Hidrogeno. Cual es la diferencia entre estos tres atomos?)El número de neutrones de un elemento químico se puede calcular como A-Z, es decir, como la diferencia entre el número másico y el número atómico. Por ejemplo, para el carbono Z=6. Es decir, todos los átomos de carbono tienen 6 protones y 6 electrones. Sin embargo, el carbono tiene dos isótopos: uno con A=12, con 6 neutrones y otro con número másico 13 (7 neutrones), que se representan como:
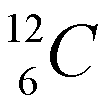
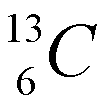
La cantidad relativa de un isótopo en la naturaleza recibe el nombre de abundancia isotópica natural. La masa atómica de un elemento es una media de las masas de sus isotópos naturales ponderada de acuerdo a su abundancia relativa. Por ejemplo, La plata (Ag) en su estado natural está constituida por una mezcla de dos isótopos de números másicos 107 y 109. Sabiendo que abundancia isotópica es la siguiente: 107Ag =56% y 109Ag =44%, el peso atómico de la plata natural se calcula como:

En general las propiedades químicas de un elemento están determinadas fundamentalmente por los protones y electrones de sus átomos y en condiciones normales los neutrones no participan en los cambios químicos. Por ello los isótopos de un elemento tendrán un comportamiento químico similar, formarán el mismo tipo de compuestos y reaccionarán de manera semejante.
Que es masa atomica?
El átomo de carbono, con 6 protones y 6 neutrones, es el átomo de carbono 12 y es la masa de referencia para las masas atómicas. Una unidad de masa atómica (u.m.a), se define exactamente como 1/12 de la masa de un átomo de carbono que tiene una masa 12 u.m.a. una masa atómica relativa molar de carbono 12 tiene una masa de 12 g en esta escala. Un mol gramo (abreviado, mol) de un elemento se define como el numero en gramos de ese elemento igual al número que expresa su masa relativa molar. Así, por ejemplo, un mol gramo de aluminio tiene una masa de 26.98 g y contiene 6.023 ·1023 átomos.
Estuctura atomica: atomo - particulas subatomicas - numero masico
 La palabra átomo proviene del idioma griego y significa “no divisible” o “indivisible” por lo que el átomo se consideraría la particular mas pequeña de la materia que no se puede dividir. Este concepto fue inventado por Demócrito en el 400 ac y en aquella época se creía que el átomo era efectivamente la particula más pequeña posible de la materia (lo cual no es cierto ya que hay partículas subatómicas)
La palabra átomo proviene del idioma griego y significa “no divisible” o “indivisible” por lo que el átomo se consideraría la particular mas pequeña de la materia que no se puede dividir. Este concepto fue inventado por Demócrito en el 400 ac y en aquella época se creía que el átomo era efectivamente la particula más pequeña posible de la materia (lo cual no es cierto ya que hay partículas subatómicas)En los átomos se reconoce la existencia de partículas con carga eléctrica negativa, llamados electrones, los cuales giran en diversas "órbitas" o niveles de energía, alrededor de un núcleo central con carga eléctrica positiva. El átomo en su conjunto y sin la presencia de perturbaciones externas es eléctricamente neutro.
Centro del núcleo se encuentran otras partícula, los protones, que poseen carga eléctrica positiva, y los neutrones que no poseen carga eléctrica. Así pues dentro del átomo encontramos:
EL ELECTRÓN : Es una partícula elemental con carga eléctrica negativa igual a 1,602 x 10-19 Coulomb y masa igual a 9,1083 x 10-28 g, que se encuentra formando parte de los átomos de todos los elementos
EL NEUTRÓN: Es una partícula elemental eléctricamente neutra y masa ligeramente superior a la del protón, que se encuentra formando parte de los átomos de todos los elementos
EL PROTÓN: Es una partícula elemental con carga eléctrica positiva igual a 1,602 x 10-19 Coulomb y cuya masa es 1837 veces mayor que la del electrón. La misma se encuentra formando parte de los átomos de todos los elementos.
En un átomo de un elemento cualquiera se tiene la misma cantidad de protones y de electrones . Esta cantidad recibe el nombre de número atómico, y se designa por la letra "Z".
A la cantidad total de protones más neutrones presentes en un núcleo atómico se denomina número másico y se designa por la letra "A".
Si designamos por "X" a un elemento químico cualquiera, su número atómico y másico se representa por la siguiente simbología:
A
X
z
Por ejemplo, para el Sodio tenemos:

Así el número de neutrones resulta de la ecuacion neutrones (n) = A - Z
3/8/09
Reglas para escritura formulas quimicas
El numero de oxidacion del hidrogeno en todos los compuestos es +1 (ejem HCl), excepto en los hidruros de un metal que es -1 (ejem. NaH)
El numero de oxidacion del O en todos los compuestos es -2 excepto en el peroxido de hidrogeno (H2O2) que es -1
Por convencion se escribe primero el simbolo del elemento quimico con numero de oxidacion positivo y luego el simbolo del elemento quimico con numero de oxidacion negativo. Ejem. NaCl (Na +1, Cl -1)
En una formula se intercambian los numeros de oxidacion (sin el signo) y se colocan como subindices Na2O (Na +1, O -2)
2/8/09
Nomenclatura Compuestos Quimicos
Hay una serie de reglas y parámetros a seguir par nombrar correctamente los compuestos químicos.
Aquí les presento una guía resumida sobre NOMENCLATURA DE COMPUESTOS INORGANICOS. La misma se ha separado en compuestos inorgánicos principales como sales, óxidos, hidruros etc.
Obviamente esta lista no está completa. Así que consulta un libro de Química General par más información y profundidad.
Nomenclatura Iones
Nomenclatura de Sales
Nomenclatura de Hidruros
Nomenclatura de Hidróxidos
Nomenclatura de Óxidos
Bienvenida Segundo Quatrimestre 2009
En Agosto comienza el Primer Cuatrimestre del 2009 (Agosto-Diciembre 2009).
Esta asignatura posee dos actividades presenciales: teoricos y practicos. Hay diversos horarios de teoricos, a los cuales Ud tiene que asistir por lo menos a uno (Recomendable, NO obligatorio). Respecto a los practicos Uds ya se debe haber inscrito en una comision (por Sistema Guarani) y debe asistir (OBLIGATORIAMENTE) a esa comison (Por ejemplo mi comision es los Lunes a las 18:30).
Tambien hay varios horarios para consultas (hay muchas oportunidades). Las consultas son para aclarar dudas sobre la materia pero NO PARA que el PROFESOR LES RESUELVA LOS PROBLEMAS. UD debe estudiar para que la consulta sea mas efectiva. El horario mío es los Miercoles a las 18:30 en la Cátedra de Química Aplicada (segundo piso) FCEFyN (Ciudad Universitaria). Pueden asistir a cualquier Horario de Consulta con cualquier PROFESORESTA MATERIA NO ES DIFICIL TAN SOLO DEBEN IR A CLASES, RESOLVER LOS PROBLEMS DE LAGUIA Y ESTUDIAR. EL PRETENDER APROBAR SIN EL ESFUERZO DE ESTUDIO CORREPONDIENTE ES SIMPLEMEMNTE ENGAñARSE A SI MISMO. SUERTE
Entrada destacada
-
Las celdas electroquímicas pueden ser de dos tipos: galvánicas o electrolíticas. Las celdas galvánicas (también llamadas voltáicas) almace...
-
Las celdas electroquímicas pueden ser de dos tipos: galvánicas o electrolíticas. Las celdas galvánicas (también llamadas voltaicas) almace...


